 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 61 篇 doi: 10.5376/mpb.cn.2011.09.0061
收稿日期: 2011年03月07日 接受日期: 2011年05月19日 发表日期: 2011年05月19日
盛德鹏等, 2011, 蛋白激发子PeaT1转化水稻恢复系多系一号的研究, 分子植物育种 Vol.9 No.61 (doi: 10.5376/mpb.cn.2011.09.0061)
来源于极细链格孢菌 (Alternaria tenuissima) 的蛋白激发子 PeaT1,具有促进植物生长、提高植物的抗旱能力和诱导植物广谱抗病性等功能。为了实现蛋白激发子 PeaT1 在水稻中的表达并进一步研究其功能,通过比较 N6、MS、NB 培养基对于水稻恢复系多系一号成熟胚愈伤组织的诱导效果,证实 N6 培养基较适合多系一号成熟胚的组织培养。在此基础上,通过根癌农杆菌(Agrobacterium mmefaciens) 介导转化法将极细链格孢菌蛋白激发子基因 peaT1 导入多系一号基因组,PCR、Northern blot 和 Western blot 分别证实了 peaT1 基因的整合、转录和表达,获得了转 peaT1 水稻恢复系多系一号植株。此研究为蛋白激发子基因peaT1 在水稻抗病、抗逆育种中的应用奠定基础。
利用转基因技术将外源基因导入水稻基因组,打破物种间的生殖隔离,改良水稻的抗性和农艺性状,是获得抗病虫、抗逆、高产、优质水稻新品种的有效途径。研究中所采用的根癌农杆菌(Agrobacterium mmefaciens) 介导的转化系统是对天然转化系统的一种模仿(Hiei et a1., 1994),具有转化频率高、导入基因拷贝数低、导入植物的片段精确、以及技术简单、成本低(Hiei et a1., 1997)的优点,通过改良培养条件、改造农杆菌菌株和表达载体,已在多种水稻品种上获得了成功应用(Upadhyaya et al., 2000; Saharan et a1., 2004; Yimian et al., 2009; Kenjirou, 2010)。
来源于极细链格孢菌(Alternaria tenuissima) 的蛋白激发子PeaT1对病原菌没有直接的毒杀作用,而是激发水杨酸、乙烯等信号传导途径,诱导植物植保素和病程相关蛋白等的产生,提高植物的抗病、抗旱 能力,促进植物生长和种子发芽(Yang et al., 2009a; Mao et al., 2010)。国内的邱德文等将来源不同的蛋白激发子转化到水稻、油菜、烟草等作物中,转基因作物均表现出了相应的抗性(Qiu et al., 2009; 邵敏和王金生, 2004),表明通过转蛋白激发子基因提高植物的抗性是可行的。
籼稻、粳稻和爪哇稻是水稻的三个亚种,其中籼稻产量最大,但是在转基因技术研究中籼稻愈伤组织的诱导、继代和植株的再生都较困难,而且品种间差异较大。杂交水稻的抗性主要决定于父本恢复系(刘殊等, 2002),通过转化杂交籼稻的恢复系获得转基因籼稻是解决这一难题的有效途径。多系一号是目前水稻育种中常用的杂交籼稻的恢复系,作为父本培育出了多种 优质高产杂交籼稻品种。本研究通过比较三种水稻组培常用的N6、MS、NB培养基(Chan et al., 1992)对多系一号成熟胚愈伤组织的诱导效果,获得适合多系一号成熟胚愈伤组织诱导的培养体系,在此基础上将peaT1转化多系一号,通过分子生物学方 法验证了外源基因在水稻中的整合、转录和表达,获得转peaT1水稻恢复系多系一号。
1结果和分析
1.1表达载体的构建
植物表达载体pCAMBIA2300-35S-peaT1-OCS的酶切、测序结果和语气完全吻合,用XbaⅠ和PstⅠ双酶切所得到的片段大小与理论值一致(图1),测序结果同样表明载体中含有目的基因peaT1并且插入位点正确。
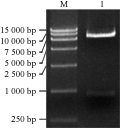
图1 植物表达载体pCAMBIA2300-35S-peaT1-OCS的酶切
Figure 1 Restriction enzymes digestion of the plant expression vector pCAMBIA2300-35S-peaT1-OCS
1.2不同培养基对多系一号愈伤组织诱导效果比较
经试验发现,N6培养基对于多系一号愈伤组织的诱导效果明显优于NB和MS培养基。诱导25 d后,N6培养基可以诱导出大量淡黄色、生理状态好的愈伤组织,而NB和MS培养基诱导出的愈伤组织量小、较松散,部分愈伤组织还出现褐化(图2)。
![]()
图2 NB, MS, N6培养基对多系一号愈伤组织诱导的效果比较
Figure 2 Performance comparison of N6, MS and NB medium
1.3转基因植株的再生
将诱导得到的生理状态好的愈伤组织侵染后共培养2 d,然后在筛选培养基上培养30 d后转移到分化培养基,大约30 d后出现抗性小苗。将小苗小心移栽到生根培养基,生根后移栽到温室得到T0代的转基因植株(图3),T0代转化植株收获种子后并繁育到T2代。
![]()
图3 转基因水稻的再生
Figure 3 Construction of transgenic rice plants
1.4转基因植株的PCR和RT-PCR检测结果
T0代转化水稻植株经过PCR初步筛选,引物1和引物2均为阳性的转基因水稻植株30株(图4)。经过RT-PCR鉴定阳性植株27株(图5)。这说明RT-PCR和PCR的结果基本吻合。T1、T2代转化水稻植株PCR和RT-PCR结果也基本一致(未显示)。
![]()
图4 水稻再生植株的PCR检测
Figure 4 PCR identification of regenerate rice plants
![]()
图5 转基因水稻的RT-PCR检测
Figure 5 RT-PCR detection of transgenic rice plants
1.5转基因植株的Southern blot分析
对RT-PCR鉴定为阳性的部分T2代植株进行Southern杂交,结果如图所示(图6):在转基因植株检测到了明显的杂交信号,转基因植株的拷贝数都在3个以下,有两株为单拷贝,而非转基因植株没有出现杂交信号,这说明peaT1基因已经整合到了转基因水稻基因组中。
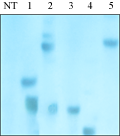
图6 转基因水稻的Southern blot分析
Figure 6 Southern bolt analysis of transgenic rice plants
1.6转基因植株的Western blot分析
选取经Southern blot鉴定阳性的4株T2代转基因水稻植株进行了Western blot分析,结果如图所示(图7),在四株T2代转基因水稻中均检测到了大小约35 kD的特异性杂交条带,设置的非转基因对照植株没有检测到杂交信号,再一次表明T2代水稻基因组中含有目的基因peaT1并得到表达。
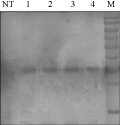
图7 转基因水稻的western blot检测
Figure 7 Western blot analysis of transgenic rice plants
2讨论
水稻成熟胚愈伤组织诱导是根癌农杆菌介导的水稻转化体系中的关键步骤,在本实验中用N6、MS和NB培养基进行多系一号成熟胚的愈伤组织诱导,结果表明, N6培养基诱导愈伤组织数量和质量都明显高于其他两种培养基,更适合于多系一号成熟胚的愈伤组织诱导。在此基础上成功的将peaT1基 因转入多系一号,通过Southern杂交鉴定获得了单拷贝的转基因植株,能够较好的为育种提供中间选育材料。但是相对于日本晴等其他粳稻品种,多系一号 还是受到诱导频率低、诱导时间长和愈伤组织生理状态不够理想的限制,对后期的转化效率造成了直接的影响。通过不同培养基大量元素和微量元素的混合使用以及 各成分之间比例系数的调配,可能能够筛选到更适合于多系一号成熟胚愈伤组织诱导的培养基种类。
随着社会的发展和科技的进步,农药残留成为 了农业生产中的一个突出问题,生物农药的出现对于缓解这一问题起到了关键的作用。蛋白激发子本身不具备杀菌作用,通过启动植物体内的防御机制是植物获得系 统抗性,无污染、无残留,已经成为新型生物农药发展的重要方向。蛋白激发子PeaT1具有热稳定性便于规模化生产提纯,不引起过敏反应还能够促进植物生长 和诱导植物产生抗病虫性,而且不会导致病虫害产生抗药性(Mao et al., 2009),应用前景广阔。目前利用基因工程手段,通过导入直接杀害或制约病虫害发展的基因,已经获得了大量高产、优质、抗病虫的农作物,这些转基因作物 大多具有一类病原物或病虫害的抗性,很少具有广谱抗性。而蛋白激发子PeaT1是通过诱导植物产生免疫反应产生对病虫害的抗性,具有广谱性,对于培养广谱 抗性的优质品种具有重要的意义。
3材料与方法
3.1植物材料、农杆菌菌株、培养基和转化载体
恢复系多系一号的成熟种子由中国水稻研究所黄世文老师赠送;蛋白激发子基因peaT1本实验室从极细链格孢菌克隆得到;试验菌株LBA4404,由本实验室保存;N6、MS、NB培养基基本成分如下表所示(表1);转化载体pCMBIA2300-35S-OCS由本实验室保存,该双元表达载体序列总长度为9.5 kb,插入peaT1后其T-DNA结构区如图所示(图8)。
图8 植物表达载体pCAMBIA2300-35S-peaT1-OCS的T-DNA结构示意图 Figure 8 Structure of T-DNA region in plant binary vector of pCAMBIA2300-35S-peaT1-OCS |
表1 水稻组培培养基基本成分 Table 1 Basic components of rice culture mediums used in the study |
3.2表达载体的构建
根据peaT1基因序列设计特异引物1 (表2),分别带有PstⅠ和XbaⅠ的酶切位点,以极细链格孢菌基因组DNA为模板扩增peaT1基因,PCR扩增反应条件为94℃预变性5 min,然后94℃ 40 s,58℃ 35 s,72℃ 1 min,35个循环,最后72℃延伸10 min。PCR产物纯化后连接到pMD18-T载体。pMD18-T-peaT1用PstⅠ和XbaⅠ进行双酶切,将切下的片段连接到经PstⅠ和XbaⅠ双酶切的pCMBIA2300-35S-OCS载体。将构建好的pCMBIA2300-35S-peaT1-Ocs载体用热激转化法转化到农杆菌LBA4404。
 表2 实验所用引物序列 Table 2 Primers used in this research |
3.3多系一号愈伤组织的诱导
将成熟的多系一号种子剥去颖壳,用75%的酒精浸泡1 min,无菌水清洗两次;再用2%的次氯酸钠处理30 min,无菌水冲洗至少3次,用无菌吸水纸吸干多余的液体。无菌种子转移到添加2.5 mg/L 2,4-D (2,4-二氯苯氧乙酸)和0.5 g/L水解酪蛋白的N6、MS、NB培养基,组织培养过程采用Toki等的方法(Toki et a1., 2006),筛选适合诱导多系一号成熟胚愈伤组织的培养基。
3.4农杆菌介导的转化体系的建立
3.4.1根癌农杆菌的制备
农杆菌接种于2 mL YEB液体培养基中,加入相应种类和浓度的抗生素,本实验所用卡那霉素和利福平的浓度均为50 mg/L,28℃、180 r/min培养过夜。菌液5 000 r/min离心3 min,倒掉上清液,菌体重悬后加入N6-As液体培养基中,As (乙酰丁香酮)的浓度为200 mg/L。测定菌体浓度,OD600在0.4~0.6之间。
3.4.2农杆菌侵染愈伤组织
选取淡黄色、紧凑的愈伤组织放入无菌的50 mL离心管,将制备好的农杆菌菌液倒入离心管内,完全浸过愈伤组织,轻轻摇动10 min。倒掉菌液,用无菌吸水纸完全吸干愈伤组织表面残留的菌液,然后将愈伤组织转移到N6-As共培培养基上,22℃黑暗条件下共培养48 h。
3.4.3筛选
共培养后的愈伤组织转移到无菌的50 mL离心管中,用含有500 mg/L卡那霉素的无菌水冲洗三次,每次轻轻摇动3 min,再用含有600 mg/L卡那霉素的无菌水清洗一次,倒掉无菌水,用无菌吸水纸吸干愈伤组织表面多余的液体。然后转移到含有500 mg/L卡那霉素和0.5 g/L水解酪蛋白的N6筛选培养基,25℃光照培养15 d后更换一次培养基。
3.4.4分化
筛选培养30 d后,将愈伤组织转移到含有0.1 mg/L KT (激动素)和0.1 mg/L NAA (α-萘乙酸)的N6分化培养基,28℃光照培养14 h,25℃暗培养10 h。30 d左右分化出小苗后,转移到含有1/2 MS和0.5 mg/L NAA的固体培养基生根,根系发达后移栽到温室培养。
3.5转基因水稻的鉴定
3.5.1 PCR和RT-PCR检测
基因组DNA提取采用北京全式金公司的植物基因组DNA小提试剂盒,RNA提取采用OMEGA公司的植物RNA小量提取试剂盒,从转化获得的T0、T1和T2代 水稻植株叶片中提取基因组DNA和总RNA。设计合成两对引物2和3 (表2),通过RT-PCR验证T-DNA的整合,引物由Invitrogen公司合成。PCR反应条件为94℃预变性5 min,随之94℃ 40 s,55℃ 40 s,72℃ 1 min 30 s,35个循环,最后72℃延伸10 min。RT-PCR按照北京全式金技术有限公司两步法RT-PCR试剂盒说明书的方法。
3.5.2转基因植株Southern blot检测
经PCR鉴定阳性的T2代转基因植株每株取4 g叶片用CTAB法提取基因组DNA,用EcoRⅤ酶切。标记探针合成使用PCR DIG Probe Synthesis Kit (Roche),以含有peaT1基因的质粒为模板,引物为根据peaT1基因序列设计的特异引物4 (表2),反应条件为94℃预变性5 min,94℃ 30 s,59℃ 30 s,72℃ 1 min 30 s,35个循环,最后72℃延伸10 min。DNA分子杂交按照罗氏地高辛检测试剂盒(Ⅱ)说明书的方法。
3.5.3转基因植株的Western blot检测
选取Southern检测阳性的T2代转基因植株叶片提取总蛋白,参照Coca等的方法进行Western blot杂交鉴定(Coca et a1., 2006)。抗体以本实验室从极细链格孢菌中纯化的蛋白激发子PeaT1为抗原制备。
作者贡献
盛 德鹏、玉山江、买买提和郭丽华是本研究的实验设计和实验研究的执行人;盛德鹏、郭丽华和曾红梅完成数据分析,论文初稿的写作;曾红梅、杨秀芬和袁京京参与 实验设计,试验结果分析;邱德文是项目的构思者及负责人,指导实验设计,论文写作和修改。全体作者都阅读并同意最终的文本。
致谢
本研究由转基因生物新品种培育重大专项(2009ZX08001-018B)资助。感谢中国水稻研究所黄世文副研究员赠送水稻种子和在实验中提供的帮助。
参考文献
Chan M.T., Lee. T.M., and Chang H.H., 1992, Transformation of Indica rice (Oryza sativa L.) mediated by Agrobacterium tumefaciens, Plant Cell Physiology, 33(5): 577-583
Coca M., Peñas G., Gómez J., Campo S., Bortolotti C., Messeguer J., and Segundo B.S., 2006, Enhanced resistance to the rice blast fungus Magnaporthe grisea conferred by expression of a cecropin A gene in transgenic rice, Planta, 223(3): 392-406 doi:10.1007/s00425-005-0069-z
Hiei Y., Komari T., Kubo T., and Tomoaki K., 1997, Transformation of rice mediated by Agrobacterium tumefaciens, Plant molecular Biology, 35(1-2): 205-218 doi:10.1023/A:1005847615493
Hiei Y., Ohta S., Komari T., and Kumashiro T., 1994, Efficient transformation of rice (Oryza sativa L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA, Plant Journal., 6(2): 271-282 doi:10.1046/j.1365-313X.1994.6020271.x
Kenjirou Ozawa., 2010, Establishment of a high efficiency Agrobacterium-mediated transformation system of rice (Oryza sativa L.), Plant Science, 176(4): 522-527 doi:10.1016/j.plantsci.2009.01.013
Liu S., Cheng H., Wang F., and Zhu Y., 2002, DNA polymorphism of main restorer lines of hybrid rice in China, Zhongguo Shuidao Kexue (Chinese Journal of Rice Science), 16(1): 1-5 (刘殊, 程慧, 王飞, 朱英国, 2002, 我国杂交水稻主要恢复系的DNA多态性研究, 中国水稻科学, 16(1): 1-5
Mao J., Liu Q., Yang X., Long C., Zhao M., Zeng H., Liu H., Yuan J., and Qiu D., 2010, Purification and expression of a protein elicitor from Alternaria tenuissima and elicitor-mediated defense responses in tobacco, Annals of Applied Biology, 156(3): 411-420 doi:10.1111/j.1744-7348.2010.00398.x
Qiu D., Mao J., Yang X., and Zeng H., 2009, Expression of an elicitor-encoding gene from Magnaporthe grisea enhances resistance against blast disease in transgenic rice, Plant Cell Reports, 28(6): 925-933 doi:10.1007/s00299-009-0698-y
Saharan V., Yadav R.C., Yadav N.R., and Ram K., 2004, Studies on improved Agrobacterium-mediated transformation in two indica rice (Oryza sativa L.), African Journal of Biotechnology, 3(11): 572-575
Shao M., and Wang J.S., 2004, Transformation of rice with hrfAxoo gene and resistance of the transgenic plant to bacterial leaf blight, Nanjing Nongye Daxue Xuebao (Journal of Nanjing Agricultural University), 27(4): 36-40 (邵敏, 王金生, 2004, 转HrfAXoo基因水稻对白叶枯病的抗性, 南京农业大学学报, 27(4): 36-40)
Toki S., Hara N., Ono K., Onodera H., Tagiri A., Oka S., and Tanaka H., 2006, Early infection of scutellum tissue with Agrobacterium allows high-speed transformation of rice, The Plant Journal., 47(6): 969-976 doi:10.1111/j.1365-313X.2006.02836.x
Upadhyaya N.M., Surin B., Ramm K., Gaudron J., Schünmann P.H.D., Taylor W., Waterhouse P.M., and Wang M.B., 2000, Agrobacterium-mediated transformation of Australian rice cultivars Jarrah and Amaroo using modified promoters and selectable markers, Australian Journal of Plant Physiology, 27(3): 201-210
Yang X.F., Qiu D.W., Zeng H.M., Yuan J.J., Mao J.J, 2009a, Purification and characterization of a glycoprotein elicitor from Alternaria tenuissima, World Journal of Microbiology and Biotechnology, 25(11): 2035-2042 doi:10.1007/s11274-009-0105-4
Yimian M., Luo L., Chengguang Z., Changhui S., Bo X., Jun F., Jiuyou T., Anding L., Shouyun C., Gupo L., Qian Q., Yongbiao X., and Chengcai C., 2009, Molecular analysis of rice plants harboring a multi-functional T-DNA tagging system, Journal of Genetics and Genomics, 36(5): 267-276 doi:10.1016/S1673-8527(08)60114-9